INTRODUCTION
Rappelons le lien originel unissant fascia et ostéopathie. En témoignent de nombreux écrits de Still , et particulièrement sa Philosophie dont le chapitre X est intégralement dédié au sujet :
"Au fur et à mesure que l’étude du fascia sera poursuivie, je crois que de riches pensées apparaîtront à l’oeil de l’esprit, plus ici que dans n’importe quelle autre division du corps"
Armé du savoir anatomo-physiologique de son époque, Still affirme que comprendre ce tissu, c’est comprendre où et comment se jouent les arcanes de la vie, de la maladie et de la mort :
"Le rôle que joue le fascia dans la vie et la mort constitue pour nous un problème majeur à résoudre - peut-être le plus grand"
Il décrit le fascia comme "système spongieux et poreux", "le mieux pourvu en nerfs, sang et globules blancs", "qui gaine, pénètre, divise et subdivise la moindre partie du corps de tous les animaux." Et de conclure :
– "Cette vie est certainement trop courte pour élucider l’utilité du fascia dans les formes animales" (Still, 1999).
La publication d’ouvrages techniques consacrés aux fascias (Gabarel et Roques, 1985 ; Paoletti, 2002 ; Chauffour et Prat, 2003) affirme encore aujourd’hui l’indéfectibilité de ce lien originel ; dimension historique qui attend toujours plus ample documentation.
S’incluant dans cette tradition, notre exposé commentera successivement divers concepts et prolongements théoriques et pratiques liés au fascia :
– 1.Continuité et unité
– 2.Autocontrainte
– 3.Dualité physique solide / fluide
– 4.Modèle de tenségrité viscoélastique
– 5.Comportement dynamique complexe.

1 CONTINUITE STRUCTURELLE, UNITE FONCTIONNELLE
"… La transition entre les tissus parenchymateux, tel le foie, par exemple, et les tissus appelés classiquement "conjonctifs", comme une lame tendineuse, n’est que quantitative. Il n’y a pas de différence qualitative essentielle entre les tissus …" (Labat-Robert et Robert, 1990)
A SYSTEME COLLAGENIQUE MULTIMICROVACUOLAIRE (Guimberteau) : ARCHEO-INTEGRATION
L’histologie nous l’enseigne : de la tête aux pieds, du revêtement cutané au centre de l’os, le corps apparaît comme un continuum tissulaire dont les parties constitutives ne différent que par leur teneur en matrice extracellulaire. Plus ou moins hydratée, plus ou moins dense, plus ou moins calcifiée et plus ou moins riche en cellules, la trame collagénique sous-tend la totalité organique selon un principe d’organisation parfaitement décrit par le concept de Système Collagénique Multimicrovacuolaire d’Absorption Dynamique ou MCVAS (Guimberteau et al., 2005, Guimberteau, 2007).
Nous sommes ainsi conviés à une conception encore plus globalisante du fascia. Alors que les fascias des anatomistes et des cliniciens pénètrent et divisent - étant envisagés anatomiquement et physiologiquement par rapport à l’élément cellulaire ici posé comme référence, tissu "noble" - le fascia ou MCVAS apparaît comme la structure mécanique fondamentale, au sein de laquelle se développe la vie cellulaire.
Plus précisément, la conception ostéopathique classique des fascias (au pluriel) repose sur l’image d’un réseau dont seul l’agencement macroscopique - modélisés individuellement comme éléments linéaires (tendons, …) ou plans (aponévroses, membranes durales, …) -, est considéré en 3D. Seul un changement de point de vue en accédant au niveau tissulaire, c’est-à-dire à l’échelle mésoscopique, rend sensible la continuité et l’épaisseur du MCVAS, son aspect multivacuolaire analogue à une mousse.
Ce qu’avaient peut-être pressenti les esprits intuitifs de l’ostéopathie naissante lorsqu’ils traitaient du fascia au singulier. Autrement dit, si les fascias séparent, le fascia unifie.
| MODE D’INTEGRATION | SUPPORT ANATOMIQUE | ENERGIE MISE EN JEU | REACTIVITE | RECEPTEURS CELLULAIRES |
| ARCHEO-INTEGRATION | Système collagénique multivacuolaire (Guimberteau) | Mécanique | + | Mécanorécepteurs : Intégrines, Cadhérines, … |
| PALEO-INTEGRATION | Sytème cardiovasculaire | Chémo-humorale | ++ | Récepteurs aux hormones, aux anticorps, … |
| NEO-INTEGRATION | Système nerveux | Electrochimique | +++ | Récepteurs à Ach, DOPA, NA … |
Tableau 1 : Modes d’intégration
Se présente ainsi une véritable assise anatomique que l’état d’autocontrainte qui la caractérise transforme en système physiologique médiateur d’une "archéo-intégration", fonctionnant essentiellement sur un mode mécanique. Le méta-niveau (méta : qui dépasse, qui englobe) évoqué précédemment (Mégret, 2004, 2006) complété par le système cardiovasculaire, support d’une "paléo-intégration" à médiation principalement chémo-humorale, et par le système nerveux, base d’une "néo-intégration" à médiation électrochimique au fonctionnement précis et rapide (mais peut-être aussi plus fragile).
Preuve en est la cellule, cible privilégiée de la plupart de ces processus, qui arbore une myriade de récepteurs membranaires spécialisés, aux afférences mécaniques (intégrines, cadhérines), aux afférences humorales d’origines vasculaire (récepteurs hormonaux, aux anticorps, …), enfin aux afférences nerveuses (Ach, NA, sérotonine, …) (Tableau 1).
| CONCEPT | DEFINITION | CORRESPONDANCE ANAT. | ASPECT PHYSIQUE | MODELISATION |
| BIOMEDICALE USUELLE (Petit Robert) | Membrane de tissu conjonctif, qui enveloppe des groupes de muscles et certains organes dont elle assure le maintien | Aponévroses, capsules, séreuses, … | Eléments de jonction, soutien ou maintien sans liens entre eux | Principes mécaniques classiques appliqués localement : poulies, leviers, empilement des segments |
| OSTEOPATHIQUE CLASSIQUE (Gabarel et Roques) | Ensemble des tissus conjonctifs, dérivés du mésoblaste | - 1 Fascias Superficiels : TC sous-cutanés – 2 Fascias Intermédiaires : Aponévroses, tendons, enveloppes externes des viscères, … – 3 Fascias profonds : Méninges, périoste, lames basales, … |
Réseau 3D d’éléments macroscopiques en 1 et 2 D (cordes et nappes) | Mêmes principes, mais agencement en vue d’une approche globale |
| NOUVEAU CONCEPT | Ensemble du Réseau Fibrillo-vacuolaire Viscoélastique Autocontraint (RFVA), extra et intra cellulaires ou Composante mécanique des structures corporelles |
- 1 Système Collagénique Multimicrovacuolaire d’Absorption Dynamique (Guimberteau)
– 2 Cytosquelette + Cytosol – 3 Matrice nucléaire + Nucléoplasme |
Continuité 3D intégrale (aspect d’une mousse) du réseau extracellulaire (MCVAS) et prolongement trans-échelles, jusqu’à la cellule et au noyau | Réseau autocontraint de type tenségrité viscoélastique. Ambivalence solide/fluide. Autosimilarité (extracellulaire, cellulaire, nucléaire) |
Tableau 2 : Les “ Fascias ”
B RESEAU FIBRILLOVACUOLAIRE VISCOELASTIQUE AUTOCONTRAINT : DEPLOIEMENT DU “FASCIA”
Plus avant, les connaissances récentes portant sur les structures cytosquelettiques (CSQ) doivent inciter à élargir notre compréhension des structures de soutien.
La conscience d’un système réticulé continu de la périphérie vers le centre - "épaisseur sensible" plus ou moins densifiée localement en fonction des contraintes - et celle d’une continuité de ce réseau jusque dans l’intimité cellulaire, voire nucléaire (Ingber, 1998), nous conduisent à élargir le concept de fascia à l’ensemble de ces structures. Fascia entièrement “déployé” que nous proposons d’appeler provisoirement Réseau Fibrillovacuolaire Viscoélastique Autocontraint (RFVA) pour en résumer les caractéristiques (Tableau 2).
Le RFVA ne constitue pas une nouvelle structure pas plus qu’il ne s’oppose aux conceptions existantes du fascia. Sa formulation est l’aboutissement d’un constat : la similitude entre le MCVAS et le CSQ, sur les plans de l’anatomie (disposition de fibres en réseau irrégulier au sein d’une matrice liquide : fibrillovacuolaire) et de la mécanique (existence d’une tension interne continue ou autocontrainte).
L’observation d’une disposition réticulaire de certains tissus et surtout l’agencement en treillis des structures musculosquelettiques, permet d’élargir le concept à l’échelle macroscopique. De la même façon, le noyau cellulaire forme une infrastructure fibrillaire. Le RFVA se déploie sur les trois échelles : macro, méso et microscopique, reliées et fondues entre elles, et présentant une autosimilarité de structure et de fonction (aspect fractal). Cet aspect a été précédemment approché avec le concept de tissu matriciel de tenségrité, formé des trois matrices : extracellulaire, cellulaire et nucléaire, oscillateur harmonique traversé par et modulant l’information mécanique définie plus haut (Pienta et Coffey, 1991).
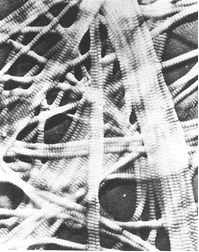
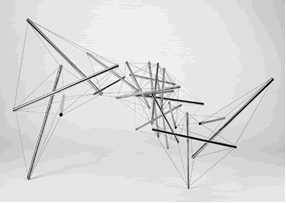
Au final, le RFVA représente le concept le plus large pour décrire la totalité des structures de soutien ou plus justement la composante mécanique des structures corporelles, puisqu’il n’est pas un seul élément du corps qui ne participe à l’édification mécanique de celui-ci (Illustrations 1, 2, 3, 4, 5).
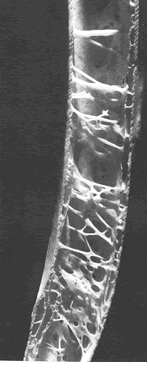
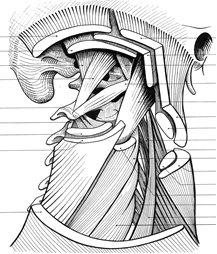
Illustrations 1 : Musculature de la nuque
2 : Coupe d’un os d’aigle
3 : Fibres de collagène
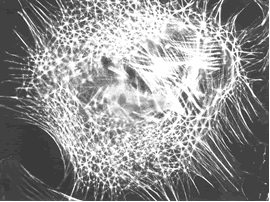
Illustrations 4 : Cytosquelette
5 : Free Ride Home, K. Snelson (1974)
2 AUTOCONTRAINTE
« Tensegrity structures are pure pneumatic structures » (Fuller, 1979)
A - GENERALITES
L’autocontrainte constitue la propriété mécanique essentielle du RFVA. En effet, seul un système déjà "sous pression" ou "sous tension" est à même d’exprimer une réponse "en temps réel", autrement dit de fonctionner sur un mode véritablement dynamique (e.g. tonus musculaire) ; les stimuli ou informations d’origine externe ou interne ne faisant que moduler un équilibre dynamique de tension, essence du système.
Il n’est qu’à envisager un animal mort pour comprendre comment cette autocontrainte est un paramètre signant la vie. Chez le cadavre, non seulement le tonus musculaire n’est plus, mais tous les tissus sont flaccides (des os du crâne se chevauchant témoignent de la mort foetale) ; les liquides, les influx, plus rien ne circulent, et rapidement l’organisme se délite ou se dessèche.
Pour de nombreuses raisons, et particulièrement le fait qu’ils actualisent idéalement le concept d’autocontrainte, les systèmes de tenségrité à barres et à câbles constituent des modèles de choix pour le RFVA (Levin, 1982 ; Ingber, 1998 ; Chen et Ingber, 1999).
Notons que l’introduction des forces générées par la phase liquidienne, ici provisoirement exclues, ne modifiera en rien le concept d’autocontrainte proprement dit (voir le chapitre suivant).
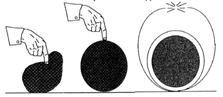
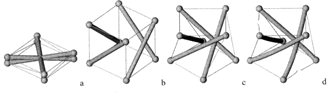
Illustration 6 : Analogies fonctionnelles entre un ballon et un module de tenségrité.
ANALOGIE DU BALLON
Pour comprendre l’autocontrainte, l’analogie du ballon s’avère incontournable (Motro, 1997). Au cours du gonflement d’un ballon, le volume gazeux est tout d’abord inférieur à la capacité de l’enveloppe.
La forme évolue macroscopiquement tout en restant mal définie jusqu’à un état d’équilibre où le ballon est rigide et parfaitement sphérique. Si le gonflage se poursuit, l’œil ne perçoit plus l’augmentation de volume. Quand le point de rupture de l’enveloppe est atteint, la destruction survient par éclatement (Illustration 6).
Dans un module de tenségrité, les câbles et les barres sont analogues à l’enveloppe et au gaz comprimé, respectivement. En matérialisant le “gonflage” par augmentation progressive de la longueur des barres, les mêmes étapes se succèdent. Une phase initiale de mécanismes finis et d’instabilité morphologique (étape b) précède l’atteinte d’un état stable (étape c) ; la poursuite du processus conduit à la ruine du module par rupture des câbles ou par flambement des barres (étape d)).
Dans ces deux exemples, on observe entre l’état à plat et l’état d’équilibre, une phase préliminaire de déploiement caractérisé par de grands déplacements sans déformation élastique, la rigidité étant nulle. Au-delà du point d’équilibre entre tension et compression, le système est porteur d’autocontrainte et sa rigidité augmente alors considérablement pour d’infimes variations de volume gazeux ou de longueur de barres, les phénomènes s’analysant dès lors en termes infinitésimaux.
Une relation de réciprocité apparaît entre la partie tendue responsable de la cohésion du système en contenant la (les) partie(s) comprimée(s) qui en assure(nt) la rigidité.
Il importe ici de rappeler ce que Levin appelle processus omnidirectionnel, lequel signifie qu’une modification de tension en un point selon une direction donnée entraîne une répartition des contraintes dans de multiples directions (Levin, 2007). Toute force ou pression aussi infimes soient-elles exercées par le thérapeute sera potentiellement redistribuée en toute direction, ce que l’observation d’une structure de tenségrité et du RFVA nous fait percevoir intuitivement.
B-NOTION D’ETATS INDEPENDANTS
Cette première démonstration serait incomplète sans examiner ce que les concepteurs entendent par état d’autocontrainte élémentaire (Raducanu, 2001). Pour des géométries simples, comme les modules réguliers, il n’existe qu’un seul état d’autocontrainte, à une constante près, exprimé par le rapport Tc/Tb entre tension des câbles et compression des barres. Par exemple pour le module icosaédrique à 30 éléments (6 barres et 24 câbles), Tc/Tb = 6-1/2 (Motro, 1997).
Pour des géométries plus complexes, modulaires ou non , le calcul permet de définir plusieurs états d’autocontrainte impliquant chacun un certain nombre d’éléments de la structure, appelés états élémentaires indépendants. C’est-à-dire qu’une modification voire la suppression de l’autocontrainte de cet état n’influent pas sur les autres états ; le système total demeure autocontraint et stable. Est ainsi définie une base des états d’autocontrainte élémentaires e1, e2, e3, …, en, où en est une matrice représentant un état indépendant, soit en simplifiant, un ensemble de valeurs de forces (tension et compression) dans les éléments (câbles et barres) impliqués dans cet état.
Si en contient des éléments groupés localement, l’état est dit local. Si les éléments sont répartis sur l’ensemble de la structure, l’état est dit global, certains éléments pouvant être communs à deux ou plusieurs états.
Toute combinaison linéaire de ces états donne un état d’autocontrainte total : E = c1e1+c2e2+c3e3+ …+cnen. Chaque état élémentaire peut être matérialisé par la coloration particulière d’une carte du système. La superposition des cartes fournit une représentation de la structure entière. La valeur des coefficients cn est choisie en fonction de différents critères.
Par exemple, on peut rechercher une rigidité accrue ou minimale dans certaines zones particulières de la structure ou une répartition uniforme. L’existence de ces états d’autocontrainte explique d’autre part que la rupture d’un câble ne provoque pas l’effondrement du système entier (Motro, 1997).
Dans le domaine biomécanique, par analogie, cette indépendance relative des sous-systèmes garantit la pérennité de l’organisme : la rupture d’un tendon d’Achille ne signe pas fort heureusement la complète destruction de l’organisme (Chen et Ingber, 1999).
Pour l’ostéopathe, morbidité signifie restriction de mobilité. Ce que l’on peut traduire très schématiquement par une (des) valeur(s) cn inadapté(es) à un (des) état(s) d’autocontrainte élémentaire(s) en, le(s)quel(s) se trouve(nt) en dysfonction, c’est-à-dire faisant obstacle au libre écoulement de l’information mécanique. Remarquons que nous restons ici dans le domaine fonctionnel, en n’est pas modifié (il n’y a pas d’organicité, à l’échelle considérée s’entend).
Remarquons également que E (totalité structurelle) ne s’appréhende jamais directement mais par l’intermédiaire des cnen, aussi bien globaux (dont les éléments sont répartis sur toute la structure) que locaux. Ils seront d’ailleurs bien rares les cas où au moins un état global ne sera pas modifié, la moindre implication d’ordre postural par exemple signant la perturbation d’un en global.
En schématisant à l’extrême, après une phase diagnostique consistant à repérer les états en dysfonction - phase capitale liée à la qualité de son doigté et à la pertinence de son raisonnement - l’ostéopathe tentera de rétablir des valeurs cn compatibles avec une bonne "perméabilité mécanique" de en, autrement dit d’aboutir à une expression harmonieuse de E.
On comprendra aisément l’importance en termes d’autocontrainte des modifications organiques accidentelles ou chirurgicales représentées par les tissus cicatriciels, exérèses et plasties, qui pourront, mais ce n’est pas obligatoire, perturber l’équilibre des tensions. Que penser également de l’influence de certaines molécules sur l’autocontrainte du RFVA, celles modifiant par exemple le tonus postural (myorelaxants, psychotropes, …) ou l’équilibre hydro électrolytique (stéroïdes, …) ?
3 DUALITE SOLIDE / FLUIDE
L’ostéopathie a toujours attaché une grande importance à la physiologie des liquides corporels ; autant aux phases closes, cardiovasculaire et cérébrospinale, qu’aux fluides interstitiels et intracellulaires.
Comme précisé plus haut, la tenségrité s’est révélée féconde comme modèle mécanique pour le RFVA. Les éléments fibrillaires s’assemblent en formations polyédriques intriquées, véritable treillis en équilibre dynamique. Mais un modèle de tenségrité élastique ne peut résumer à lui seul les propriétés mécaniques du MCVAS comme celles de la cellule ou du noyau. L’intervention des éléments liquidiens est essentielle : pression osmotique, forces de tension superficielle, interactions moléculaires, changements de phase ; en résumé une combinaison très complexe de forces générées au sein de l’élément liquide.
La tentation est grande d’identifier les éléments fibrillaires solides aux composants tendus, et la partie fluide aux composants comprimés, obtenant ainsi un maillage enserrant un gel comprimé. Compte tenu de la complexité du RFVA, il s’agirait là d’une simplification abusive, les éléments aussi bien fibrillaires que liquidiens changeant vraisemblablement de rôle mécanique en fonction des stimulations, comme le font les éléments des structures géodésiques (Chen et Ingber, 1999).
Quelle que soit l’échelle retenue, tissulaire ou cellulaire, la composante "fluidique" au sens large apparaît totalement intriquée avec les éléments "solides" du système (Gilles, 2003). Tous ces éléments sous leurs aspects structuraux et fonctionnels - anatomiques et physiologiques - sont indissociables, interagissent et travaillent dans le même sens : conserver la forme, l’intégrité de la totalité organique tout en autorisant une mobilité optimale à tous ses sous-ensembles. Nous verrons au chapitre suivant comment une structure fibrillaire viscoélastique peut voir ses paramètres rhéologiques évoluer en fonction des contraintes qui lui sont appliquées.
Retenons que le rôle de l’élément fluide dans la biomécanique doit orienter tout thérapeute à se pencher sur les grandes fonctions et organes en charge de la gestion des liquides ; reins et système cardiovasculaire, axe hypothalamo-hypophysaire, glandes surrénales et colon, principalement. Il n’est pas de traitement du ou par le fascia sans prise en compte de son paramètre fluidique, sur un plan aussi bien local que général.
4 MODELE DE TENSEGRITE VISCOELASTIQUE (Cañadas)
Les deux modèles viscoélastiques élémentaires ont été maintes fois retenus pour décrire le comportement mécanique du fascia et du CSQ :
– Le modèle de Maxwell (amortisseur et ressort montés en série) image d’un fluide viscoélastique.
– Le modèle de Voigt-Kelvin (amortisseur et ressort montés en parallèle) image d’un solide viscoélastique.
En identifiant élastine et collagène aux composantes élastique et visqueuse, respectivement, divers auteurs ont invoqué ces modèles pour illustrer le comportement du tissu conjonctif sous contrainte et partant, proposer une approche thérapeutique Ils ont ainsi donné au facteur temps toute son importance, que ce soit au niveau de la durée d’application de la contrainte pathogénique que du temps d’application des manœuvres correctrices (Upledger et Vredevoogd, 1989).
Les biomécaniciens de la cellule les connaissent encore mieux puisqu’il s’agit des modèles de base retenus pour la cellule considérée comme milieu continu.
Cependant, ces modèles trouvent rapidement leurs limitations (Ingber, 1998 ; Cañadas, 2003) :
– Les études sont faites sous l’hypothèse d’un milieu homogène.
– L’hétérogénéité architecturale et mécanique est ignorée (fibrilles du MCVAS et filaments du CSQ), en particulier le réarrangement structural des réseaux.
– Ces modèles sont uni (voire bi) dimensionnels, ignorant l’aspect tridimensionnel du RFVA.
– Pour la cellule, ils ignorent la transmission des forces à travers les complexes focaux d’adhésion ("points de soudure") de la membrane.
– Les résultats ne sont en accord avec l’expérience que sous certaines conditions étroites et leur généralisation apparaît difficile.
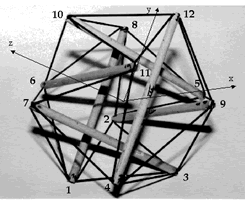

Illustration 7 : Module icosaédrique élastique
Illustration 8 : Module viscoélastique
C’est pourquoi les modèles dits structuraux ont dorénavant la faveur des chercheurs. En ce sens, Cañadas a proposé pour la cellule un modèle numérique et physique de tenségrité viscoélastique (MTV) sur une base icosaédrique à 30 éléments (décrit plus haut) où les câbles en tension suivent un comportement non plus simplement élastique mais de type solide viscoélastique (Voigt-Kelvin), en rapport avec les propriétés viscoélastiques des microfilaments d’actine responsables de la tension du CSQ (Cañadas et al., 2002 ; Cañadas et al., 2006) (Illustrations 7 et 8).
La pertinence du MTV a été largement reconnue puisqu’il a permis de rendre compte de nombreuses expériences traitant du comportement sous charges de cellules en culture (Wang et al., 1993 ; Stamenovic et al., 1996 ; Wendling et al., 2000).
En particulier, les caractéristiques rhéologiques du modèle évoluent en fonction des contraintes que celui-ci subit (traction, compression, cisaillement ou torsion) vers le raidissement ou l’assouplissement, l’épaississement ou la dilution, la fluidification ou la solidification. Selon que E (module d’élasticité de Young), (module de viscosité), et (constante de temps caractérisant la vitesse de déformation), croissent ou diminuent, respectivement.
Par exemple, une contrainte de traction entraîne un raidissement, un épaississement et une fluidification (augmentation concomitante de E, et ) du modèle, phénomène à rapprocher du comportement de la cellule. En effet, une cellule épithéliale en suspension, dont le CSQ est lâche, coule comme un fluide viscoélastique, alors que la même cellule adhérente, munie d’un CSQ conséquent se rigidifie et se solidifie (Tableau 3 repris de Cañadas 2003).
Au final, ce modèle tridimensionnel précontraint par des éléments viscoélastiques pourrait avantageusement être substitué aux modèles unidimensionnels traditionnellement retenus pour le fascia. En effet, il résume l’ensemble des propriétés examinées ci-dessus : unité et continuité, autocontrainte et aspect fluido-solide du RFVA. Plus largement, l’intérêt de ces recherches biomécaniques est évident, lesquelles montrent que des variations rhéologiques de la cellule et des tissus sont objectivables et mesurables. Pourquoi ne seraient-elles pas perceptibles par une main entraînée susceptible dans un acte thérapeutique de les guider ou de les modifier ?
| - | TRACTION | - | CISAILLEMENT | - | L* | - | T* | - |
| Epsilon i = 5% | Ei = 50% | Ei = 5% | Ei = 50% | Traction | Cisaillement | Traction | Cisaillement | |
| E* | 0,0016 | 0,0026 | 0,0004 | 0,0006 | alpha*L* -2 | alpha*L* -2 | alpha*T* 0,3 | alpha*T* 0,7 |
| Raidissement | id | Raidissement | id | Assouplissement | id | Raidissement | id | |
| Tau* | 0,22 | 0,47 | 0,72 | 0,4 | alpha*L* 0 | alpha*L* 0 | alpha*T* -0,2 | alpha*T* -0,6 |
| * | Fluidification | id | Solidification | id | Sans effet | id | Solidification | id |
| nu* | 0,0003 | 0,0012 | 0,0003 | 0,0002 | alpha*L* -2 | alpha*L* -2 | alpha*T* 0,1 | alpha*T* 0,1 |
| Epaississement | id | Dilution | id | Dilution | id | Effet non significatif | id |
– Tableau 3 :
– Synthèse des évolutions prédites dans les propriétés viscoélastiques des MTV et obtenues par simulations numériques de tests de fluage en traction et en cisaillement (Cañadas 2003) :
– Les 2 colonnes de gauche donnent les variations de E, tau et êta, en fonction de 2 niveaux de déformation epsilon, 5% et 50%.
– Exemple 1, en traction comme en cisaillement, lorsque la déformation augmente, E* augmente : le système se rigidifie.
– Exemple 2, en traction, tau varie croît avec epsilon : le comportement du modèle se rapproche de celui d’un fluide viscoélastique. En cisaillement, tau et epsilon varient en sens inverse : le modèle se comporte davantage comme un solide viscoélastique.
– Les 2 colonnes de droite donnent ces mêmes variations en fonction de L*, longueur normalisée des barres, et de T*, tension normalisée dans les câbles.
– Exemple 1, en traction, tau est proportionnel à T*-0,1, autrement dit, si L* augmente, tau diminue ; on observe une solidification.
– Exemple 2, en traction comme en cisaillement, êta est proportionnel à L*-1 ; lorsque L* croît, êta et donc la viscosité diminuent : le système évolue mécaniquement vers la dilution.
5 NON-LINEARITE
L’étude des fluctuations chaotiques en biologie se poursuit depuis une trentaine d’années. Tension artérielle (Golderberg, 1990) perception olfactive (Freeman, 1991), évolution (Dambricourt-Malassé, 1996), conscience (Debono, 2002), système postural (Bois, 2002), autant de sujets et de disciplines qui font appel au chaos déterministe.
Le rôle du chaos demeure hypothétique, mais il a été avancé que les systèmes au comportement chaotique présenteraient une meilleure souplesse, une plasticité accrue par rapport aux systèmes périodiques, qu’ils accepteraient mieux l’imprévisible .
On rapprochera de ces observations les difficultés qu’éprouvent les chercheurs à comprendre comment, à partir d’un comportement apparemment aléatoire (stochastique) à une certaine échelle (comportement des liaisons actine-myosine par exemple), émerge une comportement ordonné, régulier ou périodique, aux échelles supérieures (contraction ou relâchement d’un muscle).
Plus récemment, une nouvelle approche de la régulation posturale a été proposée avec le concept de dynamique posturale non-linéaire (DPN). La régulation posturale obéit ainsi à un fonctionnement non-linéaire où le poids causal des interactions prime sur celui des actions elles-mêmes (Bois, 2002 et 2007). En ce qui concerne le MCVAS (et plus largement le RFVA), son architecture multi-échelle auto-similaire (fractale) et l’extrême complexité de sa physiologie engagent à postuler qu’il constitue un système dynamique non-linéaire.
En première approche, on avancera que le glissement vers un registre de fonctionnement régulier et linéaire n’est peut-être pas souhaitable puisque privant le système de ses potentialités adaptatives voire évolutives.
Très schématiquement, deux registres réguliers diamétralement opposés peuvent être distingués : l’un caractérisé par l’homogénéisation, l’isotropie, l’absence de "directions" (au sens large) préférentielles, l’absorption se faisant tout azimut (par suprématie de la phase "fluide" ?, oedème ?), l’autre marqué a contrario par le renforcement de ces directions préférentielles, l’excès d’anisotropie, la perte du caractère multidirectionnel (par excès du facteur solide, réticulaire ?, cicatrice ?).
Si, en première analyse, le thérapeute devra prévenir et traiter ces manifestations (oedème ou cicatrices), il lui faudra :
– Estimer précisément leur rôle pathogénique ?
– Bien circonscrire son traitement dans l’espace et dans le temps surtout, afin de ne pas introduire d’informations en excès ou imposer un schéma arbitraire "linéarisant" à nouveau le système ; l’objectif étant de maintenir le potentiel adaptatif et créatif du système impliquant de ce fait le respect de sa dynamique et de sa complexité.
Plus largement, face à des systèmes évoluant sur des modes non-linéaires (MCVAS, posture, …), tout thérapeute se réclamant d’une approche globale de la santé devra poursuivre ses recherches bien au-delà des schémas lésionnels unidimensionnels ou d’une simple lecture symptomatique du corps souffrant. Dans la démarche diagnostique en particulier (qui demeure souvent la moins documentée en ostéopathie), la recherche et l’utilisation de tests offrant une image globale des systèmes, ouvrant sur le comportement de leurs niveaux sous-jacents et les modalités de leurs fluctuations, constituent le défi de ce début de millénaire.
Dans cette veine se fondant principalement mais non exclusivement sur des données qualitatives liées à la perception manuelle du praticien (synchronisme ?, harmonie ?), l’évaluation crânio-sacrée et le test des rotateurs (Autet, 2002) constituent une première approche qui attend de prochains développements.
CONCLUSION
Utilisé au singulier, soulignant de ce fait ses aspects unitaire et unificateur, le fascia conserve toute la place que la tradition ostéopathique lui attribue. Le fascia, vieille histoire anatomique et ostéopathique, certes, mais qui possède un réel avenir, à condition que le concept suive les avancées de l’anatomo-physiologie et de la biomécanique. La prise en compte de sa dimension spatiale continue, de ses aspects fluidiques, l’intégration du niveau cellulaire, doivent élargir le concept vers ce que nous avons provisoirement appelé le Réseau Viscoélastique Fibrillo-vacuolaire (RFVA). Le modèle de tenségrité viscoélastique proposé autorise en cela de nouvelles hypothèses théoriques et pratiques.
Ainsi, cette double continuité, au sein de chaque échelle (MCVAS, cellule, noyau) et traversant les échelles, renforce l’hypothèse d’une lecture et d’une modification des niveaux microstructuraux à partir des niveaux d’organisation sus-jacents.
REFERENCES
– Autet B. Le test des rotateurs ; actualisation et nouvelles données, invited lecture, 3e Symposium du CEOPS, Montpellier, 4&5 mai 2002.
– Bois E. "Aspects de la Dynamique Non-Linéaire et Posturologie", invited lecture, 3e Symposium du CEOPS, Montpellier, 4&5 mai 2002. in Cahiers du CEOPS 2-3, 22-27 (2002).
– Bois E. "La Dynamique Posturale Non-Linéaire, Part 1 : bases et fondements", l’Anthropologie, à paraître (2007).
– Cañadas P., Laurent V.M., Oddou C., Isabey D. and Wendling S. "A Cellular Tensegrity Model to Analyze the Structural Viscoelasticity of the Cytoskeleton". Journal of Theoretical Biology, 218, 155-173 (2002).
– Cañadas P. "Modèle de tenségrité viscoélastique pour l’étude de la réponse dynamique des cellules adhérentes". Thèse de doctorat. Dir. D. Isabey & S. Wendling Universite Paris-Val-de-Marne Paris XII. Soutenue le 20-05-2003. En ligne (consulté 04-2007) : http://tel.ccsd.cnrs.fr/documents/archives0/00/00/32/35/index_fr.html.
– Cañadas P., Wendling-Mansuy S. and Isabey D. "Frequency Response of a Viscoelastic Tensegrity Model : Structural Rearrangement Contribution to Cell Dynamics". ASME Journal of Biomechanical Engineering, 128(4), 487-495 (2006).
– Chauffour P. et Prat E. "Le lien mécanique ostéopathique". (Sully Vannes 2003) ISBN 2-911074-62-9.
– Chen CS et Ingber DE. "Tensegrity and mechanoregulation : from skeleton to cytoskeleton". Osteoarthritis and Cartilage 7, 81-94 (1999).
– Dambricourt-Malassé A. "Nouveau regard sur l’origine de l’homme". La Recherche n° 286, 46-54 (04-1996).
– Debono M.W., « Conscience et dynamique chaotique », invited lecture, 3e Symposium du CEOPS, Montpellier, 4&5 mai 2002. in Cahiers du CEOPS 2-3, 5 (2002).
– Freeman W. "La physiologie de la perception". Pour la science n° 162, 70-78 (1991).
– Fuller R. B. "Synergetics, explorations in the geometry of thinking". En collaboration avec Applewhite E.J., En ligne (consulté 04-2007) : http://www.rwgrayprojects.com/synergetics/synergetics.html. Initialement publié par Macmillan Publishing C° Inc. 1975, 1979.
– Gabarel B. et Roques M. "Les Fasciae en médecine ostéopathique. Tome 1, anatomo-physiologie et technologie". Maloine, Paris (1985) ISBN 2-224-01999-0.
– Gilles D. "L’homme en tant que système réticulé fluide organisé en structure de tenségrité", Mémoire de fin d’études d’ostéopathie. Dir. F. Laurent. Soutenu le 01-02-2003.
– Golderberg A., Rigney D. et West B. "Chaos et fractales en physiologie humaine". Pour la science n° 150, 50-57 (1990).
– Guimberteau J.C., Sentucq-Rigall J., Panconi B., Boileau R., Mouton P. et Bakhach J. "Introduction à la connaissance du glissement des structures sous-cutanées humaines". Annales de chirurgie plastique esthétique 50, 19-34 (2005)
– Guimberteau J.C. "La mécanique du glissement des structures sous-cutanées chez l’homme. Mise en évidence d’une unité fonctionnelle : la microvacuole. Plaidoyer pour une perception plus holistique, discussion sur la morphogénèse et la biogénèse", invited lecture, 5e Symposium du CEOPS, Toulouse, 17&18 mars 2007. in Cahiers du CEOPS 5, 25-32 (2007).
– Ingber D.E. "The architecture of life". Scientific American 278, 48-57 (1998). Traduction : "L’architecture de la vie". Pour la science N° 245, mars 1998.
– Labat-Robert J. et Robert L. "Intercellulaire (Matrice)". Enc. Univ. 12, 430-433 (1990).
– Levin S.M. "Continuous tension, discontinuous compression, a model for biomechanical support of the body". Bulletin of Structural Integration 8, 31-33 (1982).
– Levin S.M. "Putting the shoulder to the wheel : a new biomechanical model for the shoulder girdle". En ligne (consulté 04-2007) : http://www.biotensegrity.com/index2.php?option=com_content&task=view&id=18&Itemid=29&pop=1&page=0
– Mégret J.-F. "La tenségrité, modèle biomécanique pour l’ostéopathie". Apostill N°14, 4-16 (2004).
– Mégret J.-F. "La tenségrité, itinéraire didactique vers l’ostéopathie". 4e Symposium du CEOPS, Toulouse, 1&2 avril 2006 in Cahiers du CEOPS 4, 23-27 (2006).
– Motro R. "Tensegrity Systems- Past and Future". IASS International symposium 97 on Shell & Spatial Structures, 10&14-11-1997, Singapore, p. 69-79.
– Paoletti S. "Les fascias", (Sully Vannes 2002) ISBN 2-911074-39-4.
– Pienta K.J. et Coffey D.S. "Cellular harmonic information transfer through a tissue tensegrity-matrix system". Med. Hypoth. 34, 88-95 (1991)
– Raducanu V. "Architecture et système constructif : Cas des systèmes de tenségrité". Thèse de doctorat. Dir. R. Motro. Université Montpellier II. Soutenue le 28-09-2001.
– Stamenovic D., Ingber D.E., Wang N. et Ferdberg J.J. "A microstructural approach to cytoskeletal mechanics based on tensegrity". J. Theor. Biol. 181, 125-136 (1996).
– Still A.T. "Philosophie de l’ostéopathie". Chap. 1 “Quelques remarques préliminaires” : p. 19-31,et Chap. 10 “Le fascia” : p. 135-144, Sully, Vannes (1999) ISBN 2-911074-16-5.
– Upledger J.E. et Vredevoogd J.D. "Thérapie crânio-sacrée". Frison-Roche, Paris (1989) ISBN 2-87671-024-2.
– Wang N., Butler J., Ingber D.E. "Mechanotransduction across the cell surface and through the cytoskeleton". Science 260, 1124-1127 (1993).
– Wendling S., Planus E., Laurent V.M., Barbe L., Mary A., Oddou C. et Isabey D. "Role of cellular tone and microenvironmental conditions on cytoskeleton stiffness assessed by tensegrity model". Eur. Phys. J. A. P. 9, 51-62 (2000).
ILLUSTRATIONS
– Illustration 1 : Kapandji I.A. : « Physiologie Articulaire » fascicule III
– Illustration 2 et 3 : Gordon J.E. : « Structures et matériaux » Pour la science, Paris (1994) ISBN 2-9029-1882-8.
– Illustration 4 : Ingber D.E. : Ingber D.E. The architecture of life. Scientific American 278, 48-57 (1998)
– Illustration 5 : Snelson K. : Free Ride Home, 1974-80-aluminum & stainless steel-23.75 x 42 x 35 inches-60.3 x 106.7 x 88.9cm-.jpg : http://www.kennethsnelson.net/.
– Illustration 6 : Raducanu V. : "Architecture et système constructif : Cas des systèmes de tenségrité". Thèse de doctorat. Dir. R. Motro. Université Montpellier II. Soutenue le 28-09-2001.
– Illustration 7 : Wendling Mansuy S. : http://www.univ-paris12.fr/www/labos/lmp/StruCom/tensegrite/
– Illustration 8 : Cañadas P. : "Modèle de tenségrité viscoélastique pour l’étude de la réponse dynamique des cellules adhérentes". Thèse de doctorat. Dir. D. Isabey & S. Wendling Universite Paris-Val-de-Marne Paris XII. Soutenue le 20-05-2003. En ligne (consulté 04-2007) : http://tel.ccsd.cnrs.fr/documents/archives0/00/00/32/35/index_fr.html.
ABREVIATIONS
– MCVAS : Système collagénique multimicrovacuolaire d’absorption dynamique
– CSQ : Cytosquelette
– RFVA : Réseau fibrillovacuolaire viscoélastique autocontraint
– MTV : Module de tenségrité viscoélastique
– DPN : Dynamique posturale non-linéaire